S’adapter dans la stabilité ou comment les neurones modifient leurs connexions sans compromettre leur intégrité fonctionnelle.
Depuis plus d’un siècle, les scientifiques sont fascinés par la capacité du cerveau à changer et adapter ses circuits en fonction d’un environnement en constante évolution. Ceci étant, les processus qui nous permettent d’apprendre et de mémoriser de nouvelles informations ne peuvent avoir un sens que dans un contexte où les grandes fonctions du cerveau sont par ailleurs stables, prévisibles et reproductibles. Sans l’existence de mécanismes qui stabilisent la fonction neuronale, notre capacité à apprendre et à nous souvenir serait perdue dans le chaos du remodelage perpétuel des circuits neuronaux.
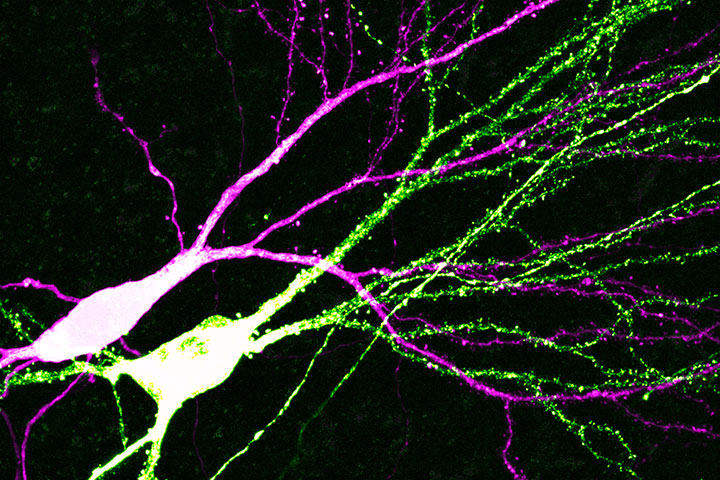
Une étude menée sous la direction de Mathieu Letellier à l’IINS, dans l’équipe d’Olivier Thoumine et en collaboration avec Alexandre Favereaux, révèle un mécanisme de plasticité homéostatique grâce auquel des connexions neuronales individuelles, les « synapses », compensent de manière autonome une diminution prolongée de l’activité neuronale en augmentant le nombre de récepteurs au glutamate. Cette étude est publiée dans la revue the EMBO Journal.
Face à des modifications prolongées de l’activité des réseaux, les neurones mettent en place des mécanismes de compensation qui maintiennent l’activité neuronale globale à des niveaux physiologiques. Par exemple, en réponse à une inactivation prolongée ou une perte sensorielle, les neurones augmentent le nombre de récepteurs à chacune de leurs synapses excitatrices, les rendant ainsi plus sensibles à la libération présynaptique de glutamate et leur permettant de restaurer leur niveau d’excitabilité, c’est-à-dire leur capacité à transmettre les informations qu’ils reçoivent. Ce phénomène appelé ‘plasticité synaptique homéostatique’ joue un rôle important pour le bon fonctionnement du cerveau mais aussi lors de pertes pathologiques de neurones et/ou de synapses, par exemple lors des phases précoces de maladies neurodégénératives comme Alzheimer. A la différence des processus d’apprentissage qui renforcent sur le long-terme et de manière sélective les connexions les plus actives (on parle alors de plasticité Hebbienne), la plasticité homéostatique est souvent décrite comme un phénomène global et non spécifique : le neurone perçoit un changement d’activité et adapte l’ensemble de ses synapses de manière uniforme, sans altérer leur diversité ni les informations qu’elles renferment.
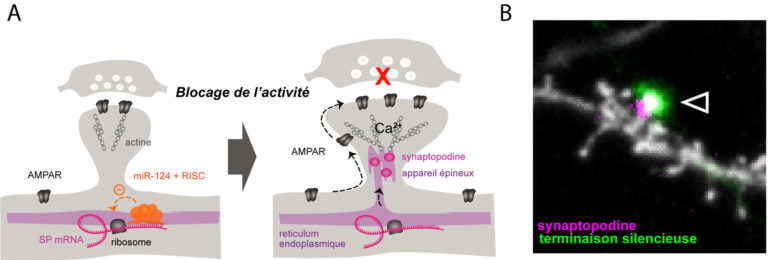
L’étude publiée dans EMBO Journal révèle au contraire un mécanisme où chaque synapse répond de manière autonome et individuelle à une diminution prolongée d’activité, en fonction de son état physiologique et biochimique propre. En combinant des approches d’électrophysiologie, de microscopie confocale et de biologie moléculaire sur cultures de neurones, cette étude montre en effet que seule une sous-population de synapses, les plus fortes et les plus grosses, augmentent leur nombre de récepteurs pour compenser la perte d’activité. Ce processus dépend d’une protéine appelée « synaptopodine » connue pour contrôler la plasticité synaptique et dont la synthèse locale est régulée par un microARN, miR-124. En utilisant une approche génétique pour bloquer la libération présynaptique de glutamate à des connexions individuelles, cette étude montre par ailleurs que des synapses isolées peuvent elles-mêmes « sentir » des perturbations locales d’activité présynaptique et, en retour, réguler leur propre activité indépendamment du reste du neurone. Cette étude fait donc évoluer la vision actuelle selon laquelle la plasticité synaptique homéostatique est un processus global et uniforme vers un paradigme plus complexe où chaque synapse réagit de manière autonome pour maintenir son propre niveau d’activité. De manière troublante et paradoxale, cette étude suggère que le neurone postsynaptique met en œuvre des mécanismes similaires que ce soit pour stocker une nouvelle information (plasticité Hebbienne) ou au contraire pour maintenir une activité stable face à une diminution d’activité (plasticité homéostatique).
Référence
miR ‐124‐dependent tagging of synapses by synaptopodin enables input‐specific homeostatic plasticity.
Sandra Dubes, Anaïs Soula, Sébastien Benquet, Béatrice Tessier, Christel Poujol, Alexandre Favereaux, Olivier Thoumine, Mathieu Letellier
The EMBO Journal. 2022-07-25.
10.15252/embj.2021109012
Contact
Mathieu Letellier
Chercheur CNRS
+ 33 5 33 51 47 67
Mise à jour: 14/09/22
