H.Zhang, D.Choquet, Y.Humeau et al. dans Nature communications
Modulation of AMPA receptor surface diffusion restores hippocampal plasticity and memory in Huntington’s disease models. Hongyu Zhang, Chunlei Zhang Jean Vincent, Diana Zala, Caroline Benstaali, Matthieu Sainlos, Dolors Grillo-Bosch, Sophie Daburon, Françoise Coussen, Yoon Cho, Denis J. David, Frederic Saudou, Yann Humeau, Daniel Choquet.
Nature Communications, volume 9, Article number: 4272 (2018)
La maladie de Huntington est une affection neurodégénérative héréditaire qui entraîne des troubles cognitifs, psychiatriques et des mouvements incontrôlés. En combinant des approches de microscopie à haute résolution avec des approches pharmacologiques, une collaboration nationale et internationale vient de mettre en évidence le mécanisme responsable du dysfonctionnement des synapses dans des neurones modèles de la maladie de Huntington. Les chercheurs ont identifié une molécule capable d’améliorer les capacités cognitives dans des modèles de souris de la maladie de Huntington. Ces résultats sont publiés dans la revue Nature Communication.
Touchant près de 20 000 Français, la maladie de Huntington (MH) est une maladie génétique rare et héréditaire due à la mutation du gène codant pour une protéine nommée huntingtine.
Il n’existe pas de traitements permettant de stopper ou ralentir la progression des symptômes. La MH est associée à la dégénérescence de neurones d’une partie du cerveau impliqués dans des fonctions motrices, cognitives et comportementales. Les mécanismes qui mènent à cette neurodégénérescence ne sont pas encore élucidés. Les symptômes de la maladie de Huntington sont nombreux et variés. Ils associent généralement des troubles moteurs, cognitifs et psychiatriques. Le symptôme le plus visible est la chorée. Elle se manifeste par des mouvements brusques et involontaires s’étendant progressivement à tous les muscles. Cependant, les troubles cognitifs apparaissent souvent précocement, évoluent parallèlement aux troubles moteurs et sont fortement invalidants.
Alors que les troubles cognitifs étaient généralement associés à la dégénérescence neuronale, plusieurs travaux récents ont suggéré que des altérations du fonctionnement des neurones de l’hippocampe – une région du cerveau impliquée dans la mémorisation – pourraient être à la base des déficits cognitifs précoces. Plus précisément, le fonctionnement des synapses, élément central de la communication du cerveau, est altéré chez les patients et les souris modèles de la MH. Cependant, les mécanismes moléculaires responsables de ce dysfonctionnement des synapses au sein de l’hippocampe n’étaient pas compris.
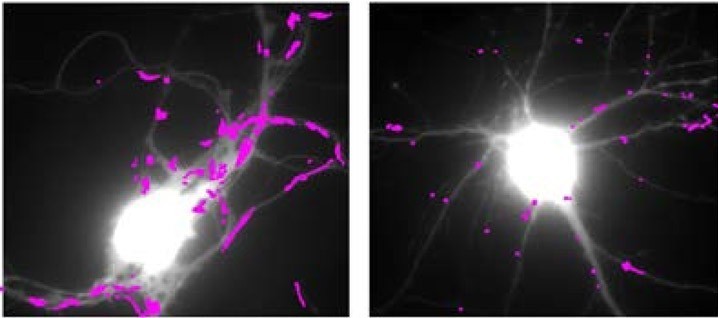
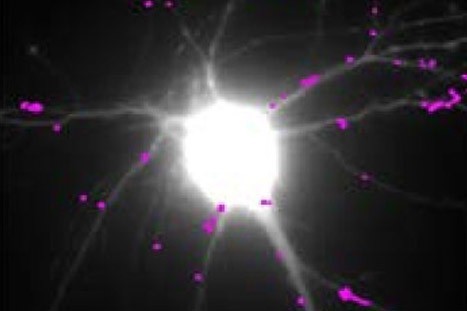
Les équipes de l’Institut interdisciplinaire de neurosciences (CNRS/Université de Bordeaux), en collaboration avec plusieurs autres laboratoires, ont mené des travaux interdisciplinaires associant des techniques d’imagerie à très haute résolution, de la biochimie et du comportement sur plusieurs modèles murins de la maladie de Huntington. Ces travaux ont permis de découvrir le mécanisme moléculaire liant la mutation de la huntingtine aux déficits de fonctionnement des synapses observés dans des modèles animaux de la maladie de Huntington: la baisse de production de BDNF (BrainDerived Neurotrophic Factor), un facteur neurotrophique essentiel au bon fonctionnement des neurones et à leur survie, induit une augmentation anormale du mouvement de récepteurs du glutamate.
Ces récepteurs sont à la base de la transmission synaptique excitatrice rapide dans le cerveau et leurs mouvements régulent l’efficacité de la transmission synaptique. Les anomalies de mouvement des récepteurs dans la MH empêchent les synapses de répondre normalement aux stimulation et sous-tend probablement les difficultés d’apprentissage des souris mutantes. Les chercheurs ont également identifié une molécule utilisée dans le traitement de la dépression – la tianeptine – capable de corriger les défauts de production de BDNF et qui restaure une mobilité normale des récepteurs du glutamate ainsi que les propriétés mnésiques des souris qui expriment la huntingtine mutée.
Ces travaux généralisent nos connaissances sur le lien entre mobilité anormale des récepteurs du glutamate et déficits cognitifs. Ils renforcent en cela un autre travail récent liant déficit de mobilité des récepteurs et défauts de fonctionnement des synapses dans la maladie d’Alzheimer, une autre affection neurodégénérative majeur. Ainsi, ils ouvrent une nouvelle piste thérapeutique pour tenter de corriger les déficits cognitifs précoces dans la maladie de Huntington.
Researchers contact / Contact chercheurs : Daniel Choquet: Institut Interdisciplinaire de Neurosciences, UMR 5297 CNRS-Université de Bordeaux Centre Broca Nouvelle Aquitaine 146 rue Léo Saignat, 33076, Bordeaux Cedex 06 82 08 90 02
Hongyu Zhang: Centre for Research on Neuropsychiatric Disorders, University of Bergen Jonas Lies vei 91, N-5009 Bergen Norway/
Frédéric Saudou: Grenoble Institut des Neurosciences Univ. Grenoble Alpes/ INSERM U894,
Mise à jour: 17/01/19
