François Georges et al. dans Nature Communications
NMDA-receptor-dependent plasticity in the bed nucleus of the stria terminalis triggers long-term anxiolysis. Glangetas C, Massi L, Fois GR, Jalabert M, Girard D, Diana M, Yonehara K, Roska B, Xu C, Lüthi A, Caille S, Georges F. Nat Commun. 2017 Feb 20;8:14456. doi: 10.1038/ncomms14456.
Une publication soutenu par le LabEx BRAIN

Ci-dessus le Dr François Georges, chef d’équipe de « Dopamine et assemblées neuronales » et les 3 premiers auteurs de cette publication, de l’Institut des maladies neurodégénératives. Ils viennent de découvrir que les réactions anxieuses occasionnées par des facteurs de stress pourraient être le reflet des changements synaptiques qui s’opèrent dans une petite région du cerveau : Le noyau du lit de la strie terminale (BNST). A travers des expériences conduites chez des rats exposés à des situations anxiogènes, les chercheurs ont disséqué un circuit neuronal qui, lorsqu’il est activé, réduit les niveaux d’anxiété de l’animal pendant plusieurs jours. Ces résultats, issus d’une collaboration entre deux laboratoires bordelais (IMN-UMR-CNRS 5293 et INCIA-UMR-CNRS 5287) et un laboratoire suisse (FMI, Basel, Switzerland) sont publiés dans Nature Communications, le 20 Février 2017.
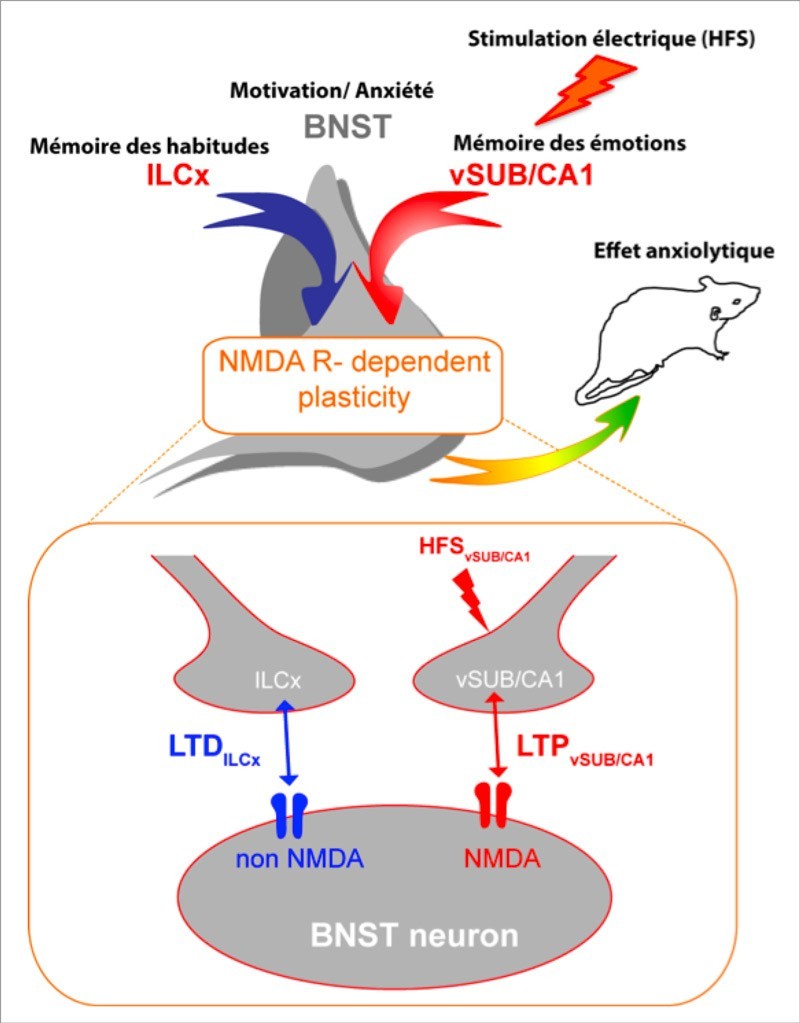
L’anxiété est une émotion physiologique qui déclenche un état d’alerte en réponse à une menace réelle ou supposée et constitue ainsi un mécanisme de survie. Le noyau du lit de la stria terminalis (BNST) appartient à un réseau neuronal de régions limbiques interconnectées et exerce un rôle central dans l’expression de l’anxiété chez de nombreuses espèces animales, et notamment chez l’Homme. Les auteurs de l’étude ont utilisé des approches virales pour tracer les voies neuronales dans trois régions cérébrales impliquées dans les comportements associés à l’état d’anxiété. Ils ont enregistré et manipulé, in vivo, l’activité électrique des neurones. Ils ont ainsi mis en évidence qu’une population de neurones du BNST (centre cérébral de la motivation et de l’anxiété), intégrait et filtrait des informations en provenance du subiculum ventral (centre cérébral de la mémoire des émotions) et du cortex infralimbique (centre cérébral de la mémoire et des habitudes) pour augmenter de façon persistante leur activité. Les conséquences de ce changement d’état des neurones du BNST sont, en particulier des changements d’état anxieux de l’animal. Les chercheurs ont ainsi pu déterminer que la mise en place d’une plasticité de type potentialisation à long terme au niveau des synapses « subiculum ventral/BNST » provoque un effet activateur et persistant (plusieurs jours) sur les neurones du BNST ayant pour conséquence de jouer le rôle d’un anxiolytique. Ce travail, en précisant les circuits neuronaux et mécanismes de plasticité synaptique qui réduisent les niveaux d’anxiété de l’animal de manière persistante, ouvre de nouvelles perspectives pour comprendre comment un changement de l’état synaptique des neurones du BNST pourrait modifier la perception de stimuli sensoriels en condition pathologique (addiction, trouble de l’anxiété). Ces travaux ont été financés notamment par l’Agence nationale pour la recherche (ANR), le CNRS et l’université de Bordeaux.

Abstract (en english)
NMDA-receptor-dependent plasticity in the bed nucleus of the stria terminalis triggers long-term anxiolysis
Anxiety is controlled by multiple neuronal circuits that share robust and reciprocal connections with the bed nucleus of the stria terminalis (BNST), a key structure controlling negative emotional states. However, it remains unknown how the BNST integrates diverse inputs to modulate anxiety. In this study, we evaluated the contribution of infralimbic cortex (ILCx) and ventral subiculum/CA1 (vSUB/CA1) inputs in regulating BNST activity at the single-cell level. Using trans-synaptic tracing from single-electroporated neurons and in vivo recordings, we show that vSUB/CA1 stimulation promotes opposite forms of in vivo plasticity at the single-cell level in the antero-medial part of the BNST (amBNST). We find that an NMDA-receptor-dependent homosynaptic long-term potentiation is instrumental for anxiolysis. These findings suggest that the vSUB/CA1-driven LTP in the amBNST is involved in eliciting an appropriate response to anxiogenic context and dysfunction of this compensatory mechanism may underlie pathologic anxiety states. Together these findings elucidate the molecular targets that contribute to changes in synaptic functions in the amBNST, and highlight important future directions where manipulation of inputs to the amBNST using opto- or chemogenetic tools may be critical for changing network output, physiological manifestations of anxiety and anxiety-associated disorders
François Georges, PhD , CNRS, IMN,
Mise à jour: 20/03/18
