Eric Hosy et al. dans Neuron
La transmission synaptique est sans cesse régulée au niveau de la pré- et de la post-synapse par des molécules et peptides appelés neuromodulateurs. Cette modulation est passe majoritairement via des récepteurs transmembranaires couplés aux protéines G (GPCR). Un des mécanisme répandu par lequel les GPCRs régulent la fonction synaptique est la régulation de la probabilité de l’exocytose des vésicules pré-synaptiques.
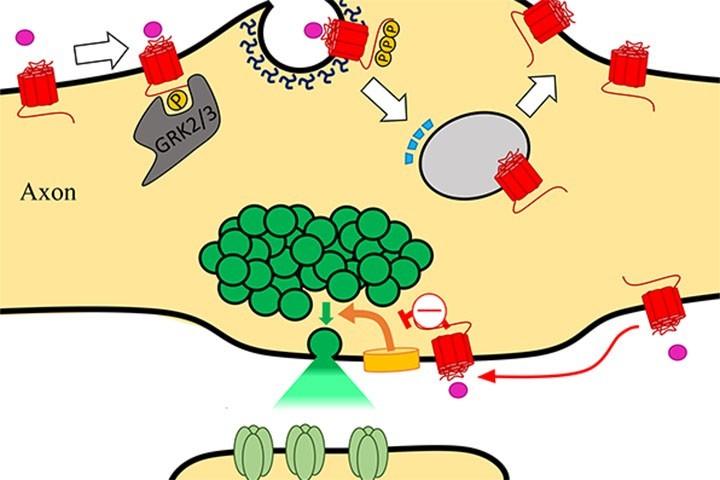
Notre compréhension actuelle du mode d’action des GPCR découle de l’étude des récepteurs métabotropiques au GABA (GABA-B) et au glutamate (mGlu). Ces GPCR s’agrègent au niveau des pré-synapses en se liant aux protéines d’échafaudage, permettant de localiser spatialement l’induction des voies de signalisation. De plus, ces récepteurs GABA-B résistent à l’internalisation dans les axones après leur activation. Ensemble, ces observations soutiennent un paradigme dans lequel la fonction GPCR à la présynapse nécessite que les récepteurs soient immobilisés à la pré-synapse et pas internalisés après activation.
Dans ce travail, Jean-Baptiste Sibarita, Eric Hosy et Hanna Zieger se sont associés avec le laboratoire de Mark Von Zastrow et plus particulièrement Damien Jullié, à San Franscisco, afin de regarder le comportement d’un GPCR appartenant à la famille A. Cette famille est la plus diverse, comportant entre autres les récepteurs à la dopamine et aux cannabinoïdes. Le mu récepteur aux opioïdes (MOR) catalyse à la fois une inhibition présynaptique et des effets postsynaptiques neuromodulateurs, et représente surtout une cible privilégiée pour les analgésiques dérivés des opioïdes.
La combinaison de la mesure des endocytoses avec les techniques de super-résolution et de modélisation informatique a permis de démontrer qu’à l’opposé des récepteurs GABA et mGlu, les MORs diffusent librement sur la membrane de l’axone, et se désactivent par endocytose une fois le ligand fixé, uniquement au niveau de la spécialisation synaptique. Le récepteur entre alors dans un cycle membranaire, indépendant du cycle des vésicules synaptiques, et est recyclé à la surface de l’axone. Ce comportement inattendu suggère que la diffusion latérale des récepteurs MOR permet la régulation de la machinerie d’exocytose des vésicules synaptiques par une stratégie différente de celle décrite précédemment. En effet, la signalisation en deux étapes pour les GPCRs permettrait aux récepteurs qui lient leur ligand en dehors de la synapse de diffuser latéralement et de transduire leur signal aux effecteurs synaptiques, optimisant ainsi la détection de ligand.
Abstract
A major function of GPCRs is to inhibit presynaptic neurotransmitter release, requiring ligand-activated receptors to couple locally to effectors at terminals. The current understanding of how this is achieved is through receptor immobilization on the terminal surface. Here, we show that opioid peptide receptors, GPCRs that mediate highly sensitive presynaptic inhibition, are instead dynamic in axons. Opioid receptors diffuse rapidly throughout the axon surface and internalize after ligand-induced activation specifically at presynaptic terminals. We delineate a parallel regulated endocytic cycle for GPCRs operating at the presynapse, separately from the synaptic vesicle cycle, which clears activated receptors from the surface of terminals and locally reinserts them to maintain the diffusible surface pool. We propose an alternate strategy for achieving local control of presynaptic effectors that, opposite to using receptor immobilization and enforced proximity, is based on lateral mobility of receptors and leverages the inherent allostery of GPCR-effector coupling.
Référence
A discrete presynaptic vesicle cycle for neuromodulator receptors
Damien Jullié, Miriam Stoeber, Jean-Baptiste Sibarita, Hanna L. Zieger, Thomas M. Bartol, Seksiri Arttamangkul, Terrence J. Sejnowski, Eric Hosy, and Mark von Zastrow
Neuron, 11 December 2019.
https://doi.org/10.1016/j.neuron.2019.11.016
Mise à jour: 17/12/19
