Daniel Jercog et Cyril Herry dans Nature
Découverte du mécanisme cérébral impliqué dans la réponse face au danger
Chez l’humain et l’animal, la réponse défensive est un mécanisme de notre cerveau qui nous permet de réagir efficacement face à un danger. L’une des principales réponse défensive est l’évitement. Mais l’évitement excessif en l’absence de menace réelle est un marqueur de pathologies liées à l’anxiété, et les mécanismes neuronaux qui en sont à l’origine sont encore mal compris. Une équipe de chercheurs de l’Inserm et de l’Université de Bordeaux au Neurocentre Magendie a récemment révélé l’interdépendance de deux régions du cerveau, l’amygdale basolatérale et le cortex préfrontal dorsomédial, dans ce mécanisme. Ces nouvelles données, publiées dans la revue Nature, permettent d’ouvrir de nouvelles pistes pour traiter les patients atteints de troubles de l’anxiété, en ciblant directement les régions du cerveau qui en sont à l’origine.
Lorsqu’un danger est proche, on retrouve chez l’humain et l’animal un mécanisme d’évitement, qui lui permet de prendre la fuite pour se protéger. Chez certaines personnes, cette réponse défensive est disproportionnée, se produit en dehors de tout danger et est symptomatique d’un trouble de l’anxiété. Connaître les mécanismes du cerveau qui sont à l’origine de cette réaction est crucial pour ouvrir des pistes thérapeutiques durables et efficaces sur les patients atteints de ces troubles.
Le rôle clé de l’amygdale et du cortex préfrontal dans la réponse d’évitement
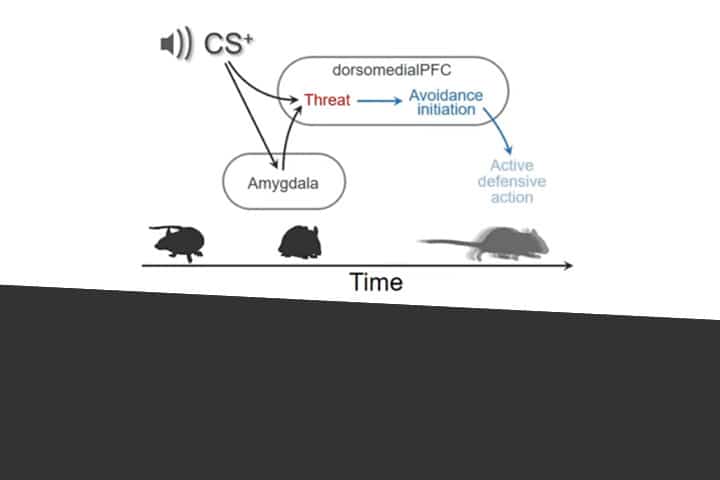
Il existe deux principales réactions défensives : l’immobilité lorsque le danger est éloigné, et l’évitement lorsqu’il est proche. Si les mécanismes de la première sont bien connus des scientifiques car plus faciles à étudier (il est en effet plus simple d’observer les modifications neuronales sur un animal immobile) ceux de la seconde demeurent mal connus. Depuis ces dix dernières années, les scientifiques savaient que deux régions du cerveau, l’amygdale basolatérale et le cortex préfrontal dorsomédial, étaient impliquées mais ignoraient dans quelle mesure elles travaillaient ensemble pour déclencher cette réaction d’évitement.
L’équipe de Cyril Herry au Neurocentre Magendie a observé chez les souris les mécanismes neuronaux-sous-jacent à l’origine de l’évitement. Pour cela, les chercheurs ont placé des souris dans un labyrinthe composé de deux compartiments. Dans l’un d’eux, un son désagréable était émis, associé à une menace. La souris avait alors la possibilité de fuir dans l’autre compartiment, arrêtant ainsi le son associé à un danger.
Pour comprendre le rôle de l’amygdale et du cortex préfrontal dans cette stratégie d’évitement, les chercheurs ont désactivé temporairement ces deux régions chez les souris pendant l’expérience. Ils ont ensuite utilisé les approches optogénétique[1] couplées à des enregistrements de l’activité électrique des neurones, afin de manipuler et d’observer en temps réel au niveau neuronal les modifications comportementales qui se produisaient. Le résultat est significatif : au moment où la souris reçoit le stimulus auditif, quelle que soit la région désactivée (amygdale ou cortex préfrontal), la réponse d’évitement est fortement perturbée. Cela démontre le rôle clé de ces deux régions du cerveau, à la fois dans la reconnaissance d’une menace, et dans la réponse d’évitement.
En outre, les chercheurs ont découvert que le cortex préfrontal associe non seulement le son à une menace, mais contrôle l’action à venir. En effet, une seconde avant que la décision de fuir ne soit prise chez la souris, les chercheurs ont constaté une activation des neurones dans le cortex préfrontal. L’amygdale intervient ensuite pour faire persister au sein du cortex préfrontal cette association entre le son désagréable et la prise de décision de l’animal. Le maintien de cette information dans le cortex préfrontal grâce à l’amygdale est ce qui permet in fine à l’animal de prendre la décision de fuir.
Le mécanisme d’évitement est donc conditionné par l’interaction entre l’amygdale et le cortex préfrontal.
Une avancée prometteuse pour traiter les troubles de l’anxiété grâce à l’intelligence artificielle
L’intelligence artificielle permet de prédire le comportement de l’animal à partir de schémas de l’activité neuronale passée. Néanmoins cette technique avait rarement été appliquée dans les recherches liées aux comportements émotionnels.
Dans cette étude, l’IA a été mobilisée pour prédire le comportement de l’animal en présence d’une menace, et cette technique est tout-à-fait applicable à l’humain.
Bien que cette méthode n’aie encore jamais été testée chez l’homme, « il serait possible avec l’intelligence artificielle de prédire ,en fonction d’un enregistrement en temps réel de l’activité du cerveau, quel va être le comportement de tel ou tel individu dans une situation émotionnelle négative et éventuellement de développer des outils qui permettent réguler en temps réel les modifications neuronales qui y sont associées » souligne Cyril Herry, co-auteur de l’étude. Il s’agit d’une avancée importante pour les patients atteints de stress post-traumatique ou d’anxiété généralisée, qui ont une réaction d’évitement excessive en l’absence de menace réelle. Pouvoir prédire les modifications neuronales associées à cette anxiété permettra de traiter les symptômes en temps réel, et d’en cibler les causes physiologiques profondes.
[1]L’optogénétique consiste à modifier génétiquement certaines cellules neuronales pour les rendre sensibles à la lumière. Cela permet par exemple d’activer ou d’inhiber certains neurones bien ciblés grâce à un rayon de lumière, sans toutefois affecter les neurones voisins. Ainsi, cette technique permet de trouver des liens de causalité entre des activités neuronales et des manifestations comportementales.
Source : Communiqué de presse Inserm
Comment in video
Scientific summary
Coping with threatening situations is at the core of mammal’s defensive systems. Defensive behavior is supported by a large network of neuronal structures including the basolateral amygdala (BLA) and dorso-medial prefrontal cortex (dmPFC). One of the main defensive responses when facing a danger is avoidance behavior, which are learned responses that allow an animal to prevent the occurrence of an aversive event. Excessive avoidance in the absence of a real threat is a hallmark of pathological conditions such as anxiety-related disorders. This is why it is important to understand avoidance behavior underlying neuronal mechanisms.
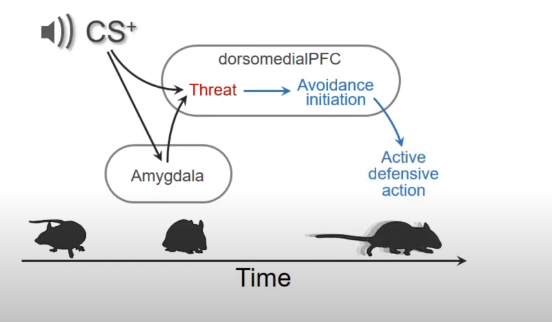
The main concept developed in our study is about how sensory information and avoidance behavior are dynamically encoded in the dmPFC, a structure involved in both goal-directed behavior and emotional regulation. To address these questions, we use a combination of behavioural approaches, in vivo electrophysiology, pharmacology and optogenetics, together with advanced video tracking and machine learning techniques.
We use an active avoidance task, where mice are placed in a maze with 2 symmetric compartments and challenged with 2 auditory stimuli. One, that we call CS+, is associated with an unpleasant shock after 7 seconds. Another sound, that we called CS–, is neutral. In addition, shuttling from the current compartment cancels any ongoing sound and contingent shock, and this defines an avoidance response. Mice learn to discriminate the 2 sounds by selectively avoiding to CS+.
We performed single-unit recordings in the dmPFC and analyzed the data by using artificial intelligence tools. We first observe that, despite the discrete structure of the sound used (sound-pips), neuronal populations in the dmPFC maintain information about the presence of CS+, even during the absence of auditory inputs (in between sound-pips). In contrast, this is not occurring during CS– presentations. When we inactivate the amygdala while recording the dmPFC, we observe that avoidance to CS+ is dramatically impaired. Moreover, although dmPFC neuronal decoders still show information about the presence of the sound-pips, the information about CS+ in between sound-pips is missing, showing that the dmPFC relies on the BLA to construct sustained representations of threats from associated sensory inputs.
While dmPFC strongly represents CS+ at the onset, it does not predict avoidance behaviour. However, right before starting the avoidance running response, dmPFC contains information about the upcoming avoidance action. This, in contrast, is not observed when we consider analogous spontaneous run movements, indicating that the dmPFC neuronal signature we observe before the avoidance run is specific to the impending avoidance action. Finally, to study the causal role of the dmPFC activity in avoidance behaviour we performed time-specific inactivations using optogenetics. When we briefly inactivate the dmPFC at the onset of the CS, we induce a delay in the time in which avoidance responses are performed. Also, when we inactivate the dmPFC after CS onset, we reduce the avoidance response probability. This later result confirms that there is a dynamic process taking place in the dmPFC linking threats with the initiation of defensive actions.
Over the past decades, it has been clear that the BLA plays a key role in threat-related behavior. However, in recent years it has also become evident that the prefrontal cortex regulates threat responses. In this study we show that the BLA is necessary to link the representations of a CS with threat. Moreover, the dmPFC is also necessary to dynamically link this threat representation with defensive actions. Finally, this dynamic process is critical to define the temporal evolution of avoidance behavior.
First author
Daniel Jercog
Post doc in Cyril Herry’s team
https://www.researchgate.net/profile/Daniel-Jercog
Contact
Cyril Herry
Team leader – Team « Neuronal circuits of associative learning »
https://orcid.org/0000-0003-2973-0843
Reference
Dynamical prefrontal population coding during defensive behaviours
Daniel Jercog, Nanci Winke, Kibong Sung, Mario Martin Fernandez, Claire Francioni, Domitille Rajot, Julien Courtin, Fabrice Chaudun, Pablo E. Jercog, Stephane Valerio and Cyril Herry
https://doi.org/10.1038/s41586-021-03726-6
Mise à jour: 31/08/21
