A. Castellanos-Jankiewicz, O. Guzmán-Quevedo, et D. Cota dans Cell Metabolism
Commentaire
L’obésité et ses maladies associées, telles que le diabète de type 2, sont un problème de santé majeur. A l’heure actuelle, les thérapies efficaces et durables pour le traitement de l’obésité impliquent la chirurgie plutôt que des interventions comportementales ou pharmacologiques. Les patients qui subissent une chirurgie bariatrique non seulement perdent du poids, mais présentent également une rapide rémission du diabète. Les mécanismes qui conduisent à ces changements métaboliques bénéfiques restent largement inconnus et font l’objet d’intenses recherches. Toutefois, malgré son efficacité, la chirurgie n’est pas une option thérapeutique adaptée pour de nombreux sujets obèses. Ainsi, la compréhension des mécanismes biologiques responsables de la perte de poids et des améliorations métaboliques induits par la chirurgie est cruciale pour que les voies affectées puissent être ciblées de manière moins invasive et plus spécifique.
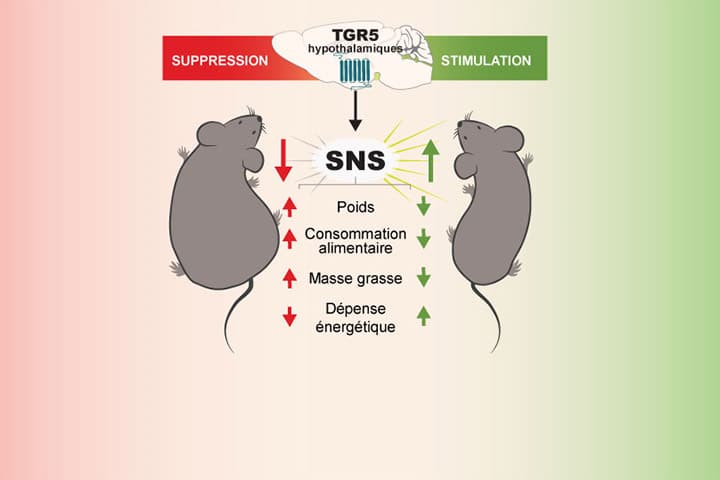
Les acides biliaires sont aujourd’hui reconnus comme l’un des principaux acteurs des bénéfices de la chirurgie bariatrique. Ces sont des molécules synthétisées dans le foie à partir du cholestérol et qui participent à la digestion des lipides après un repas. Une certaine quantité d’acides biliaires circule aussi dans le sang. Ces molécules peuvent alors activer des récepteurs spécifiques dit TGR5 qui sont exprimés par les organes périphériques et par exemple augmenter la dépense énergétique en agissant directement au niveau du tissu adipeux, facilitant la perte de poids.
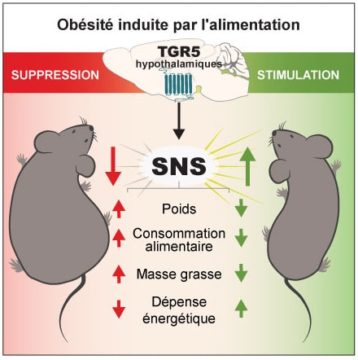 Au-delà de cette action au niveau des organes périphériques, notre étude montre que les acides biliaires circulants peuvent aussi atteindre l’hypothalamus, une structure du cerveau qui joue un rôle clé dans la régulation du poids et du métabolisme de l’organisme entier. Cette structure cérébrale exprime elle aussi des récepteurs TGR5. Chez des souris rendues obèses, le système de détection hypothalamique des acides biliaires parTGR5 est défectueux et l’activation pharmacologique des récepteurs TGR5 cérébraux amène à une diminution du poids et de la masse grasse. Ces bénéfices sont obtenus grâce à une augmentation de l’activité du système nerveux sympathique (SNS) qui accroit la dépense énergétique. Au contraire, l’inhibition de l’expression et de l’activité des récepteurs TGR5 dans des neurones de l’hypothalamus facilite le développement et la progression de l’obésité. Ainsi, le système hypothalamique de détection des acides biliaires par TGR5 nous protège de l’obésité.
Au-delà de cette action au niveau des organes périphériques, notre étude montre que les acides biliaires circulants peuvent aussi atteindre l’hypothalamus, une structure du cerveau qui joue un rôle clé dans la régulation du poids et du métabolisme de l’organisme entier. Cette structure cérébrale exprime elle aussi des récepteurs TGR5. Chez des souris rendues obèses, le système de détection hypothalamique des acides biliaires parTGR5 est défectueux et l’activation pharmacologique des récepteurs TGR5 cérébraux amène à une diminution du poids et de la masse grasse. Ces bénéfices sont obtenus grâce à une augmentation de l’activité du système nerveux sympathique (SNS) qui accroit la dépense énergétique. Au contraire, l’inhibition de l’expression et de l’activité des récepteurs TGR5 dans des neurones de l’hypothalamus facilite le développement et la progression de l’obésité. Ainsi, le système hypothalamique de détection des acides biliaires par TGR5 nous protège de l’obésité.
Abstract
Bile acids (BA) improve metabolism and exert anti-obesity effects through the activation of the Takeda G protein-coupled receptor 5 (TGR5) in peripheral tissues. TGR5 is also found in the brain hypothalamus, but whether hypothalamic BA signaling is implicated in body weight control and in obesity pathophysiology remains unknown. Here we show that hypothalamic BA content is reduced in diet-induced obese mice. Central administration of BA or a specific TGR5 agonist in these animals decreases body weight and fat mass by activating the sympathetic nervous system, thereby promoting negative energy balance. Conversely, genetic downregulation of hypothalamic TGR5 expression in the mediobasal hypothalamus favors the development of obesity and worsens established obesity by blunting sympathetic activity. Lastly, hypothalamic TGR5 signaling is required for the anti-obesity action of dietary BA supplementation.
Together, these findings identify hypothalamic TGR5 signaling as a key mediator of a top-down neural mechanism that counteracts diet-induced obesity.
Référence
Hypothalamic bile acid-TGR5 signaling protects from obesity.
Castellanos-Jankiewicz A, Guzmán-Quevedo O, Fénelon VS, Zizzari P, Quarta C, Bellocchio L, Tailleux A, Charton J, Fernandois D, Henricsson M, Piveteau C, Simon V, Allard C, Quemener S, Guinot V, Hennuyer N, Perino A, Duveau A, Maitre M, Leste-Lasserre T, Clark S, Dupuy N, Cannich A, Gonzales D, Deprez B, Mithieux G, Dombrowicz D, Bäckhed F, Prevot V, Marsicano G, Staels B, Schoonjans K, Cota D.
Cell Metabolism. 2021 Apr 19:S1550-4131(21)00175-3.
doi: 10.1016/j.cmet.2021.04.009.
Contact
Neurocentre Magendie
Mise à jour: 25/05/21
