Francesca De Giorgi, Florent Laferrière, François Ichas et al dans Science Advances
Quand des fibrilles « furtives » d’alpha-synucléine prennent le dessus
L’alpha-synucléine, petite protéine impliquée dans la régulation de la neurotransmission neuronale, est associée à plusieurs maladies neurodégénératives, comme la maladie de Parkinson (MP), la démence à corps de Lewy et l’atrophie multisystématisée (MSA). L’alpha-synucléine est une protéine particulièrement flexible dont la conformation oscille entre différentes formes. En condition pathologique, l’alpha-synucléine cesse d’osciller entre différentes conformations et reste « figée» dans une conformation particulière à l’origine de son empilement et de la formation d’agrégats amyloïdes fibrillaires. Il est maintenant admis que ce processus est auto-entretenu et similaire à une propagation de type prion.
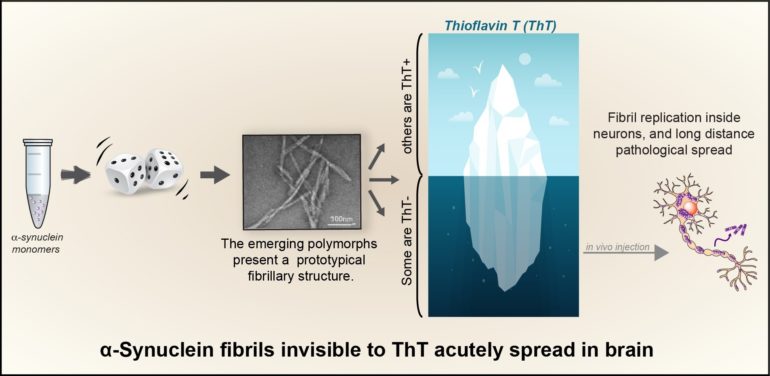
Récemment, grâce aux avancées de la biologie structurale, il a été montré que plusieurs types de fibrilles (appelés polymorphes) peuvent être produits expérimentalement in vitro, à partir d’alpha-synucleine monomérique. La possibilité que ces différents polymorphes soient responsables des différentes présentations cliniques des synucléinopathies, fait encore l’objet d’intenses recherches.
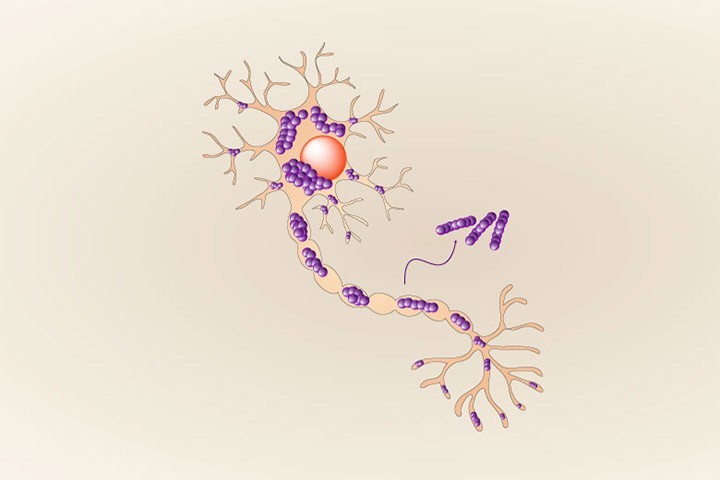
Dans une étude publiée dans Sciences Advances, De Giorgi et al. montrent que l’alpha-synucléine en solution saline peut adopter de manière stochastique plusieurs repliements amyloïdes et former autant de polymorphes. Certains de ces polymorphes étaient cependant, jusqu’à présent, passés inaperçus. En effet, les auteurs de cette étude ont fait une découverte inattendue: la sonde fluorescente thioflavine T (ThT), couramment utilisée dans le domaine pour détecter la fibrillogénese de l’alpha-synucléine, ne détecte pas tous les polymorphes émergents; certains d’entre eux restant indétectables par cet outil de référence historique. Le groupe multidisciplinaire de chercheurs emmené par le Dr François Ichas, associant les équipes de Drs. Erwan Bezard et Antoine Loquet, a montré que: (1) ces nouveaux polymorphes d’alpha-synucléine présentent une propension particulière à l’auto-réplication dans les neurones en culture, et (2) que leur injection in vivo, dans la substance noire, déclenche une synucléinopathie qui se propage sur de longues distances vers plusieurs structures cérébrales antérieures. Ces polymorphes ThT-négatifs ne correspondent à aucune des structures précédemment caractérisées. Ceci indique que des polymorphes, auparavant passés inaperçus, peuvent proliférer dans la population fibrillaire et être à l’origine d’une synulceinopathie particulièrement invasive.
Cette découverte est d’une importance particulière pour l’avancée de nos connaissances sur les synucléinopathies. Traditionnellement utilisée pour détecter les formes fibrillaires d’alpha-synucléine,. la ThT a conduit à ignorer les polymorphes ThT-négatifs et a concentré l’essentiel de l’effort de recherche sur « la partie émergée de l’iceberg », c’est-à-dire les seules fibrilles ThT-positives.
Pour identifier rapidement à la fois les polymorphes ThT positifs et négatifs, De Giorgi et al. ont développé un test multiplex, le «Fibrilloscope». Ce test pourrait devenir un outil essentiel, en particulier pour éviter de confondre l’émergence de polymorphes ThT-négatifs avec des inhibitions de fibrillogénèse, lors de la recherche de thérapies inhibant l’agrégation de l’alpha-synucléine.
Cette étude démontre que l’émergence spontanée stochastique de polymorphes ThT-invisibles peut avoir lieu pendant la préparation standard de fibrilles d’alpha-synucléine. L’emergence de tels polymorphes peut-elle avoir lieu chez les patients et contribuer à la formation et la propagation des inclusions cytopathologiques dans les synucléinopathies? Soutenant cette possibilité, l’équipe du Dr. Claudio Soto vient de rapporter, dans un article publié dans la revue Nature, que les fibrilles d’alpha-synucléine amplifiées à partir d’échantillons de liquide céphalo rachidien provenant de patients atteints de MP présentaient un signal ThT bien plus important que celles amplifiées à partir d’échantillons de patients MSA.
La possibilité que des polymorphes fibrillaires « furtifs » d’alpha-synucléine – auparavant ignorés – puissent avoir une pertinence clinique, devrait stimuler un nouvel effort de recherche visant à les caractériser de manière approfondie.
Article
Novel self-replicating alpha-synuclein polymorphs that escape ThT monitoring can spontaneously emerge and acutely spread in neurons
Francesca De Giorgi1,2,3*, Florent Laferrière1,2*, Federica Zinghirino1,2,4, Emilie Faggiani1,2, Alons Lends5, Mathilde Bertoni5, Xuan Yu6, Axelle Grélard5, Estelle Morvan7, Birgit Habenstein5, Nathalie Dutheil1,2, Evelyne Doudnikoff1,2, Jonathan Daniel8, Stéphane Claverol9, Chuan Qin6, Antoine Loquet5, Erwan Bezard1,2, François Ichas1,2,3†
Sciences Advances – October 2, 2020
1 CNRS, Institut des Maladies Neurodégénératives, UMR 5293, Bordeaux, France.
2 Université de Bordeaux, Institut des Maladies Neurodégénératives, UMR 5293, Bordeaux, France.
3 INSERM, Laboratoire de Neurosciences Expérimentales et Cliniques, U-1084, Université de Poitiers, Poitiers, France.
4 Dipartimento di Scienze Biomediche e Bio-tecnologiche (BIOMETEC), Università degli Studi di Catania, Catania, Italia.
5 Institut de Chimie et de Biologie des Membranes et des Nano-objets, Institut Européen de Chimie et Biologie, CNRS, UMR 5248, Université de Bordeaux, Pessac, France.
6 Institute of Laboratory Animal Sciences, China Academy of Medical Sciences, Beijing, China.
7 Université de Bordeaux, CNRS, INSERM, UMS3033/US001, Institut Européen de Chimie et Biologie, Pessac, France.
8 Institut des Sciences Moléculaires, CNRS, UMR 5255, Université de Bordeaux, Talence, France.
9 Plateforme de Protéomique, Université de Bordeaux, Bordeaux, France.
*These authors contributed equally to this work.
†Corresponding author.
Correspondant
 François Ichas
François Ichas
Institut des Maladies Neurodégénératives (Université de Bordeaux / CNRS)
Email:
Twitter : @FrancoisIchas
Mise à jour: 19/11/20