M. Bourdenx et al dans Science Advances
Machine Learning et maladie de Parkinson : mise en évidence de nouvelles signatures de la maladie
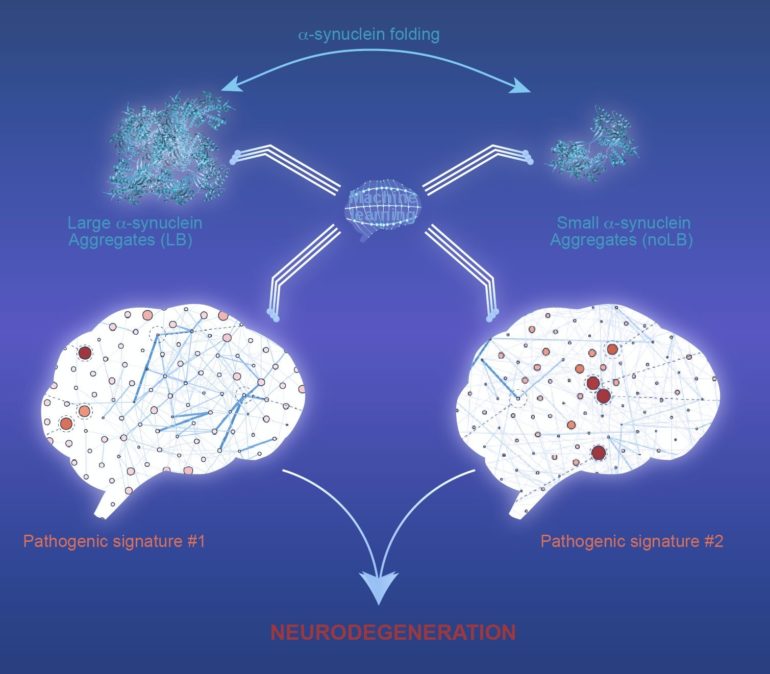
La maladie de Parkinson est caractérisée par la perte de neurones situés dans une partie du cerveau appelée substantia nigra pars compacta. Le nombre de ces neurones, qui produisent de la dopamine, diminue progressivement au cours du vieillissement. Dans le contexte pathologique qu’est la maladie de Parkinson, ces neurones dopaminergiques meurent prématurément, donnant lieu aux symptômes caractéristiques de la maladie. La raison pour laquelle ces cellules dégénèrent n’est pas claire et fait l’objet de nombreuses recherches. Pour répondre à cette question, les chercheurs ont, entre autres, recours à l’utilisation d’une variété de modèles animaux. Une étude récente publiée dans Science Advances montre que l’injection d’alpha-synucléine, protéine jouant un rôle central dans le développement de la maladie de Parkinson, induit la dégénérescence des neurones dopaminergiques, chez les primates non humains. Et cela, qu’elle soit sous une forme de large ou de petits agrégats. En revanche, les expériences sur des rongeurs, utilisées dans 85% des études, montrent que les petits agrégats d’alpha-synucléine n’induisent pas de neurodégénérescence.

En 2014, cette même équipe, composée de chercheurs espagnols et français, a montré que les formes pathologiques de l’alpha-synucléine, présentes dans le cerveau des patients décédés de la maladie de Parkinson, étaient capables d’amorcer un processus pathologique de type parkinsonien, à la fois chez la souris et le primate. « Notre idée était alors d’utiliser les mêmes agrégats humains pour caractériser plus finement comment ces larges agrégats pouvaient engendrer la mort des neurones, en les comparant avec de plus petits agrégats. », a expliqué l’auteur principal de cette étude, Erwan Bezard, PhD, de l’Institut des Maladies Neurodégénératives, Université de Bordeaux, France. « À notre plus grande surprise, alors que ces petits agrégats d’alpha-synucléine n’induisent pas de mort cellulaire chez la souris, l’injection de petits agrégats chez le primate non humain, induit la neurodégénérescence des neurones dopaminergiques, similaire à celle induite par les larges agrégats.” Pour les auteurs, ces résultats fournissent de nouvelles informations sur la façon dont la maladie est initiée et amplifiée. Ils montrent également que, chez les primates non humains, les petits agrégats d’alpha-synucléine sont aussi toxiques que les fibrilles amyloïdes plus larges. Ceci est particulièrement important à l’heure de choisir le modèle animal pour étudier les mécanismes d’action de l’alpha-synucléine, et renforce le besoin d’utiliser les primates non humains pour la recherche préclinique.
Afin de mieux comprendre comment l’agrégation d’alpha-synucléine est capable d’activer des processus pathologiques, les auteurs ont eu recours au Machine Learning. Ils ont développé un algorithme, appelé “Multiple Layer Perceptron”, capable de dévoiler des patterns à partir d’une grande quantité de données biologiques. Le perceptron a permis d’identifier diverses voies pathologiques induites après l’injection de petits et larges agrégats, menant toutes à la mort des neurones dopaminergiques. Cela signifie que selon le type d’agrégats d’alpha-synucléine, les mécanismes pathologiques conduisant à la mort des neurones sont distincts. « Cette étude est un excellent exemple de la façon dont nous pouvons utiliser le Machine Learning pour découvrir et prédire la toxicité de l’alpha-synucléine. Elle a entre autres permis de confirmer la nature multifactorielle des synucléinopathies », explique le Dr. Bezard.
Grâce au Machine Learning, on peut maintenant avoir une vision d’ensemble de la physiopathologie de la maladie de Parkinson. Cette maladie, incroyablement complexe et multiforme, affecte des millions de personnes dans le monde. L’utilisation du machine learning est peut-être la prochaine étape pour expliquer les mécanismes de dégénérescence neuronale ainsi que la progression des symptômes. Cela pourrait avoir des retombées importantes pour l’identification de nouvelles cibles thérapeutiques.
Référence de l’article
M. Bourdenx*, A. Nioche*, S. Dovero*, M.-L. Arotcarena*, S. Camus, G. Porras, M.-L. Thiolat, N. P. Rougier, A. Prigent, P. Aubert, S. Bohic, C. Sandt, F. Laferrière, E. Doudnikoff , N. Kruse, B. Mollenhauer , S. Novello, M. Morari, T. Leste-Lasserre, I. Trigo Damas, M. Goillandeau, C. Perier, C. Estrada, N. Garcia-Carrillo, A. Recasens, N. N. Vaikath, O. M. A. El-Agnaf , M. T. Herrero, P. Derkinderen, M. Vila, J. A. Obeso, B. Dehay||, E. Bezard||Science Advances 13 May 2020; 6 : eaaz9165 DOI: 10.1126/sciadv.aaz9165
* These authors contributed equally to this work.
|| These authors contributed equally to this work as co-last authors.
https://advances.sciencemag.org/content/6/20/eaaz9165
Contact
Mise à jour: 28/05/20
