David Perrais et Matthieu Sainlos dans Nature Communications
Commentaire
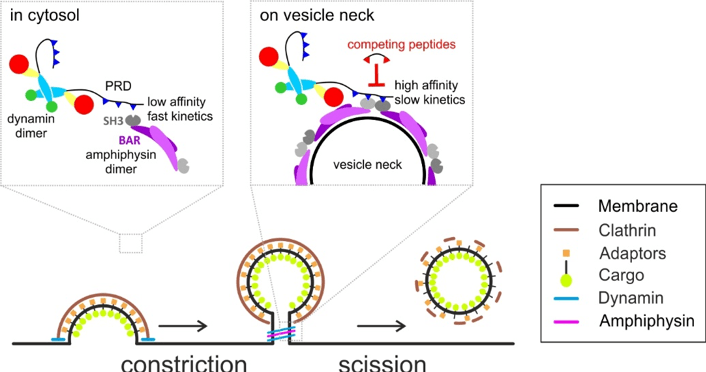
L’endocytose, la formation de vésicules à partir de la membrane plasmique délimitant la surface cellulaire, est un processus essentiel des cellules. Elle est impliquée par exemple dans le recyclage local des vésicules synaptiques, composants de base des synapses du cerveau. Les vésicules d’endocytose sont créées par l’action successive de nombreuses protéines qui déforment la membrane plasmique en un bourgeon et qui finissent par couper la membrane. Cette dernière étape de coupure est accomplie par la GTPase dynamine qui est recrutée au cou des vésicules en formation par d’autres protéines interagissant directement avec la dynamine. Cependant, ces interactions sont labiles et beaucoup de protéines différentes impliquées dans l’endocytose peuvent potentiellement être impliquées. Par conséquent, la question de savoir comment la dynamine est recrutée efficacement pour la dernière étape de formation des vésicules, et donc comment elle peut être modulée ou bloquée, restait encore en suspens. David Perrais, Matthieu Sainlos et leurs collaborateurs dans l’équipe de Daniel Choquet ont combiné des techniques d’imagerie de fluorescence de l’endocytose dans les cellules vivantes et la chimie des peptides pour mettre au point de nouveaux outils pour comprendre et interférer spécifiquement avec l’endocytose. Ils ont montré que la dynamine doit interagir simultanément avec deux molécules de la protéine amphiphysine pour être recrutée. Ceci ne peut se produire que quand l’amphiphysine s’assemble autour du cou de la vésicule en formation, expliquant de façon élégante le recrutement rapide et opportun de la dynamine (voir Figure). Ce faisant, ils ont construit de nouveaux peptides multivalents à haute affinité et spécificité pour bloquer l’endocytose. Ces nouveaux outils permettront de déterminer le rôle de l’endocytose dans différents processus cellulaires comme la transmission synaptique et sa plasticité, la motilité cellulaire ou encore l’entrée de virus.
Mise à jour: 14/10/19
